Miosina, un approfondimento della fisiologia muscolare
Miosina: approfondimento alla fisiologia muscolare
In questo articolo analizziamo in maniera approfondita la contrazione muscolare a livello fisiologico, infatti il focus dell’elaborato sarà rivolto alla funzione della miosina in tale processo.
Per evitare di dilungarsi in argomenti già trattati, prendete visione dell’articolo scritto dal Dottor Corrado Galazzo “La struttura muscolare e la contrazione muscolare”. Una volta appresa la meccanica della contrazione muscolare si potrà procedere con la lettura di questo articolo.
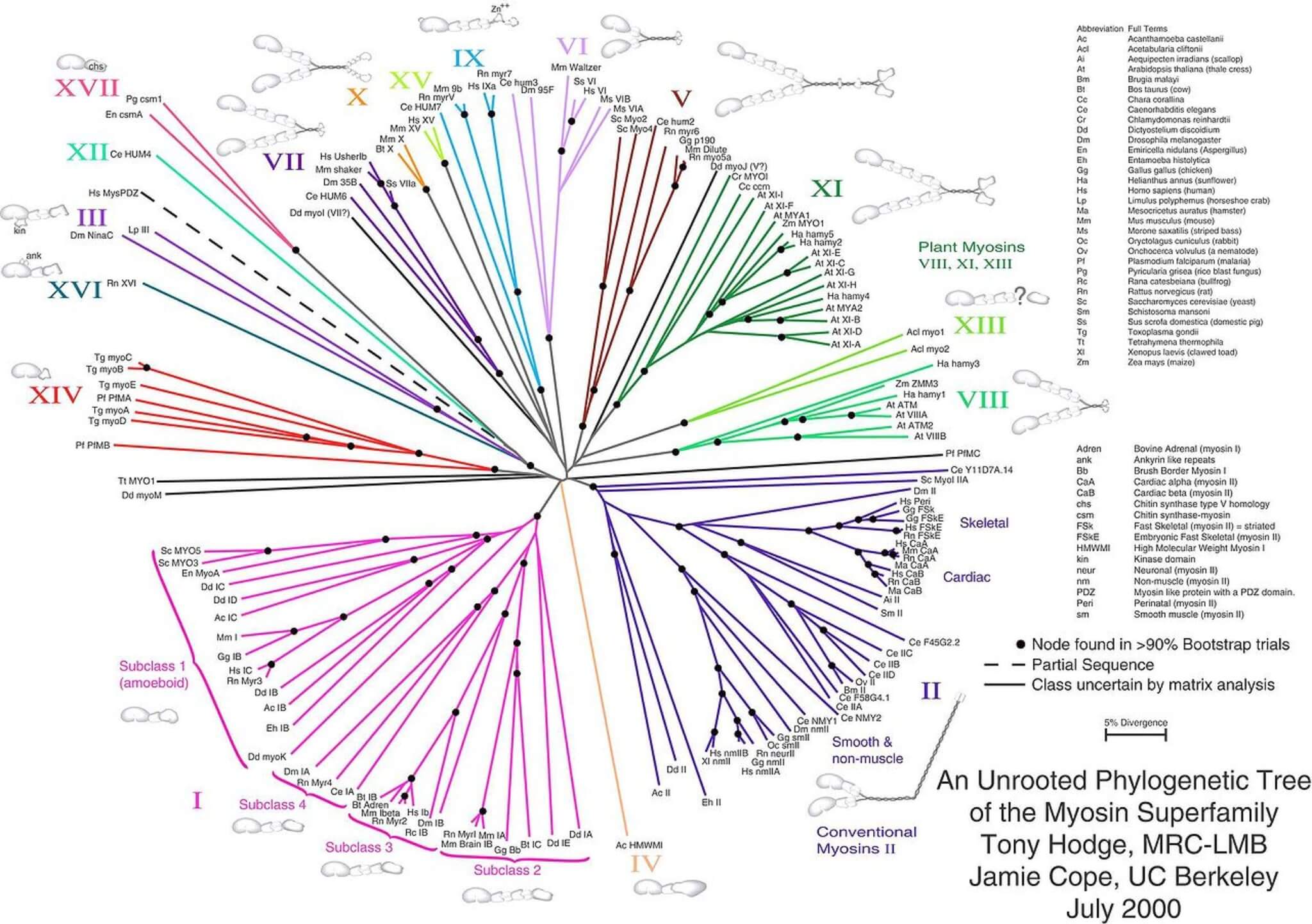
La superfamiglia della miosina
La miosina II, ovvero la miosina del muscolo scheletrico, fa parte di una superfamiglia di molecole motrici che convertono l’energia derivata dall’idrolisi dell’ATP in lavoro meccanico.
Questo tipo di proteina è stata la prima ad essere individuata e studiata, ed è l’isoforma maggiormente espressa nell’organismo umano. Oltre che nella contrazione muscolare, le molecole della miosina sono implicate in molte importanti funzioni della motilità cellulare.
Ad esempio la miosina III è coinvolta nell’organizzazione delle stereociglia dei recettori dell’orecchio. La miosina VI ha funzioni di legame con molecole shuttle per il trasporto intracellulare. La miosina V può far scorrere quattro volte di più un filamento per ogni idrolisi rispetto alla miosina II, questo è dato da una maggior lunghezza del suo collo.
I miofilamenti spessi
I miofilamenti spessi sono costituiti da molecole di miosina II, ciascuna delle quali è formata da due catene pesanti e quattro leggere. Sono microfilamenti della lunghezza di 1,5 micrometri intervallati da uno spazio di 45 nanometri formando l’intera banda A.
Presentano ponti trasversali di interconnessione reciproca, che nell’insieme costituiscono la stria M e i ponti di connessione con miofilamenti sottili ai lati della banda H.
Le metà C-terminali delle catene pesanti sono avvolte ad alpha-elica formando la coda della molecola. Le metà N-terminali delle catene pesanti formano due teste globulari, cui sono associate le due coppie di catene leggere. Le code sono rivolte verso la parte centrale del mio filamento spesso, corrispondendo alla banda H del sarcomero, mentre le teste sono rivolte verso le estremità del miofilamento spesso e sporgono in fuori verso i miofilamenti sottili ai quali si collegano durante la contrazione.
La tripsina per comprendere la miosina
La molecola di miosina è scindibile sperimentalmente dall’enzima tripsina in due frammenti:
- Meromiosina pesante (HMM): contenente la testa e il primo tratto della coda;
- Meromiosina leggera (LMM): contente la restante parte della coda.
I punti su cui agisce questa proteasi corrispondono a due brevi tratti delle catene lunghe. Infatti questi punti non rappresentano una struttura ad alpha-elica, ma sono rettilinei e pertanto più flessibili. Questo permette durante la contrazione di fare in modo che la testa si inclini verso la coda e ai due segmenti di inclinarsi verso i filamenti di actina.
A cura del Dottor Samuele Cravanzola
Ti è piaciuto l’articolo? Sostieni il nostro progetto Condividendolo!
BIBLIOGRAFIA – REFERENCES:
- Conti F et al (2001). Fisiologia medica seconda edizione. Edi-ermes. Milano. pp. 245-246.
- Hodge T & Cope M (2000). A Myosin Family Tree. Journal of Cell Science; 113: 3353-335.
- Pasqualino A & Panattoni GL (2015). Anatomia umana: citologia, istologia, embriologia, anatomia sistematica. Edra. Milano. pp. 188-189.
- Weineck J (2013). Biologia dello sport. Calzetti e Mariucci. Perugia. pp. 36.